الحرارة والقانون الأول للديناميكا الحرارية
Heat and the first law of thermodynamics
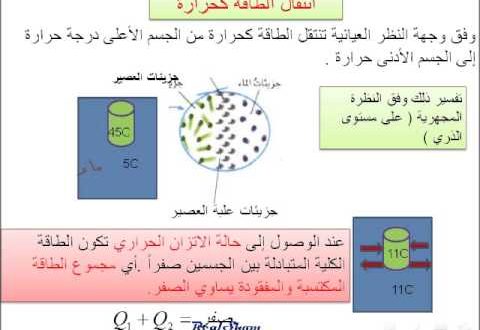
القانون الأول للديناميكا الحرارية نعلم من المحاضرة السابقة أنه عند وضع جسمين عند درجات حرارة مختلفة وكان بينهما اتصال حراري thermal contact فإن الحرارة تنتقل من الجسم الأعلى درجة حرارة إلى الجسم الأقل درجة حرارة، ويسمى هذا تدفق حراري heat flow ويستمر حتى يصل الجسمين إلى نفس درجة الحرارة وعندها يكونا في حالة اتزان حراري Thermal Equilibrium.
حاول العلماء في القرن السابع عشر تفسير ظاهرة التدفق الحراري بافتراض جسيمات غير مرئية تدعى الكلوريك Caloric، تعمل على نقل الحرارة بين الأجسام. ولكن كان هذا الافتراض غير صحيح حيث لا يمكن تفسير العديد من الظواهر الحرارية مثل عدم تغير درجة الحرارة عند حالة التحول من الحالة السائلة إلى الحالة الغازية مثل غليان الماء، ولكن العالم جول Joule اثبت بالتجربة العملية أن التدفق الحراري ما هو إلا انتقال للطاقة وأن الحرارة صورة من صور الطاقة.

تعريف الحرارة Heat
في الحقيقة كلمة حرارة هي اختصار للانسياب الحراري أو التدفق الحراري لأنه لا يوجد حرارة الا إذا انتقلت من مكان إلى آخر ولتعريف الانسياب الحراري نقول أنه هو انتقال الطاقة من مكان لآخر نتيجة لاختلاف درجات الحرارة بينهما.
The word of ”heat flow” is an energy transfer that take place as a consequence of temperature difference only.
أي أن التدفق الحراري أو الانسياب الحراري هو انتقال للطاقة .
تعريف درجة الحرارة Temperature
يجب الا نخلط بين الحرارة ودرجة الحرارة فكما ذكرنا قبل قليل ان حرارة تعني انتقال للطاقة أما درجة الحرارة فهي مقياس للطاقة الداخلية للمادة، وكلما زادت درجة الحرارة زادت الطاقة الداخلية أي زادت الطاقة الحركية لجزيئاته.
وحدة الحرارة Unit of Heat
قبل ان يتمكن العلماء من معرفة أن الحرارة هي طاقة أي قبل تجربة العالم جول الشهيرة التي اثبت فيها أن الحرارة هي صورة من صور الطاقة والتي سنشرحها بعد قليل فقد اعطى العلماء وحدة الكلوري calorie للحرارة وعرفت الكلوري على انها مقدار الحرارة اللازمة (الطاقة) لرفع درجة حرارة جرام واحد من الماء من 14.5oC إلى 15.5oC.
The unit of heat is ”calorie” which is defined as the amount of heat (energy) required to raise the temperature of 1g of water from 14.5oC to 15.5oC.
وبعد أن اثبت العالم جول أن الحرارة هي طاقة فيمكن التعبير عن وحدة الحرارة بالجول وقد اثبت عملياً أن:
1cal = 4.186J or 1J = 0.2389cal
المكافئ الميكانيكي للحرارة The mechanical *****alent of heat
قام العالم جول بتصميم التجربة الموضحة في الشكل المقابل والتي اثبت فيها أن الطاقة الميكانيكية تتحول إلى حرارة وان الحرارة ما هي إلا صورة من صور الطاقة ويمكن تحويلها من صورة إلى أخرى.
تعتمد التجربة على قياس التغير في طاقة الوضع للأثقال التي تحرك المروحة داخل الإناء المعزول، نتيجة للاحتكاك بين المروحة والماء ينتج عنها ارتفاع في درجة حرارة الماء، وبدراسة التغير في طاقة الوضع mgh مع ارتفاع درجة حرارة الماء في الإناء وجد العالم جول ان العلاقة بين طاقة الوضع والارتفاع في درجة الحرارة هي علاقة طردية. وأن ثابت التناسب يساوي 4.186J/Kg.Co
وهذا يعني أن مقدار 4.18 جول من الطاقة تلزم لرفع درجة حرارة جرام واحد من الماء درجة مئوية واحدة من 14.5oC إلى 15.5oC وهذا هو نفسه تعريف الكالوري إذا فإن
1cal = 4.186J
Example
A student eats a dinner rated at 2000 (food) Calories. He whishes to do an *****alent amount of work in the gymnasium by lifting 50Kg mass. How many times must he raise the weight to expend this much energy? Assume that he raises the weight a distance of 2m each time and no work is done when the weight is dropped to the floor.
Solution
Since 1 (food) Calories = 1000 cal then the work required is 2x106cal.
Converting this to joule, then the work required is
W = 2x106cal x 4.186J/cal = 8.37x106J
الشغل المبذول لرفع الاثقال لمسافة h يساوي mgh والشغل الكلي لرفع الأثقال عدة مرات يعطي بالعلاقة nmgh وعليه فإن عدد مرات رفع الاثقال هو
W = nmgh = 8.37x106J
Since m = 50 Kg, and h = 2m
n = 8.54×103 times
اي انه يلزم الطالب رفع الثقل ما يقارب 8500 مرة لحرق السعرات الحرارية المطلوبة ولو كان يؤدي كل رفعة في زمن مقداره 5 ثواني فهذا يعني انه يلزمه 12 ساعة لانجاز المهمة.
 موقع المهندس موقع المهندس بيت كل مهندس
موقع المهندس موقع المهندس بيت كل مهندس