ديناميكا حرارية أو تحريك حراري أو ثرموديناميك (Thermodynamics)
ديناميكا حرارية تعبر عن أحد فروع الميكانيكا الإحصائي الذي يدرس خواص انتقال الشكل الحراري للطاقة بشكل خاص و تحولاته إلى أشكال أخرى من الطاقة. يقوم هذا العلم باستخدام الميكانيك الإحصائي لصياغة القوانين التي تحكم تحول الطاقة من شكل إلى شكل، والإتجاه الذي تفضله الطاقة الحرارية في انتقالها، والطاقة المتاح تحويلها إلى عمل (Work). معظم هذه الدراسات تعتمد على فكرة أن أي جملة، أو نظام، معزولة في أي مكان من الكون تحتوي كمية فيزيائية قابلة للقياس ندعوها الطاقة الداخلية للجملة (System) ويرمز لها بالرمز (U). وتمثل هذه الطاقة الداخلية مجموع الطاقة الكامنة (Potential Energy) والطاقة الحركية (Kinetic Energy) للذرات والجزيئات ضمن الجملة، أي جميع الأنماط التي يمكن أن تنتقل مباشرة كالحرارة، وبالتالي يتم أستثناء الطاقة الكيميائية (المختزنة ضمن الروابط الكيميائية)أو الطاقة النووية (الموجودة ضمن نوى الذرات) بإعتبارها أشكال طاقية لا يمكن نقلها ضمن الشروط الطبيعية. تبقى الطاقة الداخلية (U) ثابتة حتى يتم فك العزل عن الجملة فتصبح قادرة على تبادل الطاقة أو المادة من الجملة و إليها، عندئذ يمكن للطاقة الداخلية أن تتغير عن طريق انتقال المادة أو انتقال الحرارة أو انجاز عمل .
أسهل التراجم هي الديناميكا الحرارية ، وهي مأخوذة من الأصول اليونانية therme و dynamics والأولي تعني حرارة والثانية طاقة . ورغم أن أي إنسان لديه إحساس ما بما تعنيه كلمة الطاقة إلا أنه من الصعب إعطاء تعريف جازم لهذه الكلمة ، إلا أنه يمكن تصورها علي أنها القدرة علي بذل عمل.
يهتم علم الديناميكا الحرارية كما يدل الاسم بالحرارة أو الطاقة الحرارية بدرجة أولى وبكل الظواهر التي تظهرأو تتعلق بهذه الطاقة كعملية انتقال الحرارة من جسم لآخر أو كيفية تخزين هذه الطاقة أو توليدها، يبنى كل علم على مفاهيم أساسية سوف نتعرف عليها بدقة ثم نستعرض القوانين التي تربط هذه المفاهيم بعضها البعض. يقوم علم الديناميكة الحرارية على 4 قوانين كبرى وهي القانون صفر (أو القانون الرابع) و القانون الأول و القانون الثاني و القانون الثالث. المفاهيم الأساسية للحرارة هي كمية الحرارة ودرجة الحرارة والحرارة النوعية.
كمية الحرارة : الحرارة إحدى صور الطاقة وتنتقل من نقطة لأخرى أو من جسم لآخر إذا كان هناك فرق في درجات الحرارة ، وتقاس كمية الحرارة بوحدة الطاقة وهي الجول.
درجة الحرارة : كان هناك خلط بين مفهومي درجة الحرارة وكمية الحرارة، ولكن تعرف درجة الحرارة الآن بأنها مقياس الإتزان الحراري ونعني بهذا الحالة التي عندها لا تنتقل الحرارة من نقطة لأخرى وذلك لعدم وجود فارق في درجات الحرارة. وتقاس الحرارة بوحدات مئوية أو فهرنهتية أو مطلقة. وتقاس درجات الحرارة بأنواع مختلفة من مقاييس الحرارة أهمها مقياس الحرارة السائلي، ومقياس الحرارة الغازي، ومقياس الحرارة البلاتيني، ومقياس الحرارة ذو المزدوجة الحرارية، وأخيراً مقياس الحرارة المسمى بالبيومتر الضوئي.
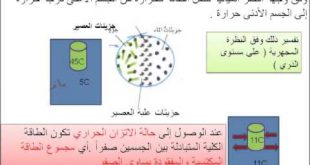
الحرارة النوعية : تعرف بأنها كمية الحرارة اللازمة لرفع درجة حرارة كيلوجرام واحد من المادة درجة مئوية واحدة أو مطلقة وبذا تكون وحدتها هي سعرة حرارية لكل كيلوجرام لكل درجة. القانون الأساسي في الحرارة: لنربط الكميات السابقة في القانون التالي Q = M C dt أي أن كمية الحرارة اللازمة لرفع درجة حرارة كتلة معينة من المادة فرق في درجات الحرارة dt هو حاصل الضرب الكتلة في الحرارة النوعية في فرق درجات الحرارة ويكون الناتج بالطبع بالجول.
انتقال الحرارة
تنتقل الحرارة بثلاثة طرق هي
التوصيل ، والحمل ، والاشعاع.
1- 2- 3-
انتقال الحرارة بالتوصيل:
لنتصور قضيباً مساحة مقطعة A مزوداً من الجوانب ودرجات الحرارة عند طرفيه هما T1 ، T2 وقد وجد أن : Q/T = q` ~ A*(T1-T2)/L or q = K dT/dX حيث q = q`/A من هنا يمكن تعريف معامل التوصيل K بإنه كمية الحرارة التي تنتقل عبر وحدة المساحات في وحدة الزمن إذا كان فارق درجات الحرارة الوحدة وطول القضيب الوحدة ، وواضح أن وحدات K هي وات /متر.درجة
انتقال الحرارة بالحمل :
كلنا نعلم أن الحرارة في السوائل والغازات تنتقل
القانون صفر
إذا كانت حرارة الجسم أ تساوي حرارة الجسم ب وحرارة ب تساوي حرارة س فإن حرارة أ تساوي حرارة س
القانون الأول
أو ان الطاقة في النظام= الشغل المبذول+ الطاقه الداخليه مفاده أن تغير الطاقة في نظام ما يساوي الطاقة الحرارية ( المضافة أو المنتزعة) زائد الشغل (المضاف أو المنتزع)
القانون الثاني
يتعلق القانون الثاني بالإعتلاج أو الأنتروبية وينص على مبدأ أساسي يقول بأن تغيرا تلقائيا في نظام فيزيائي لا بد و ان يترافق بازدياد في مقدار اعتلاج هذا النظام . ويفيد بأن تدفق الإعتلاج إلى داخل النظام ناقص تدفق الإعتلاج إلى خارج النظام زائد الإعتلاج المتكون داخل النظام تساوي صفرا .
القانون الثالث للترموديناميك
من المستحيل تبريد نظام إلى درجة الصفر المطلق .
هذا القانون يحدد درجة الصفر المطلق كحد طبيعي لا يمكن تعديتها إلى أقل منها. حقيقة أنه يمكن بأداء شغل كبير الاقتراب من درجة الصفر المطلق ، مثلما يحدث عند دراسة الميوعة الفائقة للهيليوم-3 حيث تصل درجته الحرجة للميوعة الفائقة عند 0026و0 كلفن .
قوانين أخرى
من أهم الخصائص المدروسة
الحرارة T
الضغط P
الحجم V
طاقة داخلية U
الإعتلاج أو إنتروبية S
السخانة H (التغير في الانثالبى تساوى التغير في الطاقه عند ثبوت الضغط لان H=pv+U)
السرعة
العلو
و يمكن تقسيم هذه الخصائص إلى :
حالية حرارية(كالحرارة و الضغط و الحجم) أو حالية كالورية (كالطاقة الداخلية و الإعتلاج و السخانة)
حالية ( أي انها تعبر عن حالة للمادة وهي كل الخصائص المذكورة أعلاه) و عملياتية ( أي أنها لا تو جد إلا بو جود عملية كعملية انتقال الحرارة من جسم للآخر، وعلى ذلك فهي تمثل تغير حالة المادة. من هذه الخصائص الشغل)
المعادلة الحرارية
من أهم القوانين التي ترسم العلاقة بين الضغط و الحرارة و الحجم و الكتلة في الغازات:
حيث Ri هو ثابت الغازات ولكن هذه العلاقة ليست الوحيدة وهي كذلك ليست صحيحة صحة مطلقة حيث أنه أعتمد في اشتقاقها على بعض المسلمات التي تمثل تبسيطا للواقع. حيث تم الحساب بالغازات المثالية أي أن ذرات أو جزيئات الغاز ليس لها حجم و أنه لا توجد قوى بين الجزيئات كما أن الجزيئات لا تغير شكلها أي بمعنى في حالة تصادم جزيئان يكون التصادم مرنا ، أي لا يحدث أن يمتص جزيئا جزءا من الطاقة خلال التصادم .
معادلة فان دا فالس
معادلة فان دا فالس هي أيضا معادلة حرارية ( معادلة تحتوي على خصائص حرارية تسمى معادلة حرارية).
(p+(a/v²)*(v-b)=Ri*T
حيث a و b تصحيح للمسلمات الخاطئة أعلاه.
أنواع تغير الحالة
تحول عكوس: تحول لا متناه في البطء يمكن للنظام (الجملة الترموديناميكية) في أي نقطة منه العودة في الاتجاه المعاكس معيدة وبدقة تامة جميع الشروط التي قد مرت بها في التحول الأصلي المباشر.
تحول لاعكوس: تحول سريع غير قابل للعكس و تتصف جميع التحولات الطبيعية بأنها لاعكوسة.
الدورة المغلقة: تحول تعود فيه الجملة إلى نقطة البدء بعد أن تكون قد مرت بعدة مراحل.
 موقع المهندس موقع المهندس بيت كل مهندس
موقع المهندس موقع المهندس بيت كل مهندس 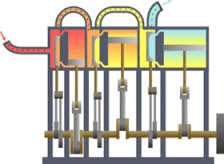

مهندس مسائك عسل
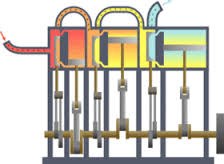
اريد مساعدتك في استغلال حرارة ولهب خارجة من ماسورة اريد توليد طاقة كهربائية منه
ولك شكري وتقديري