في عام 1869 كان مارسلين بيرثولد يعتقد أن التفاعلات الكيميائية التي تنشر حرارة هي وحدها الممكنة. وشمل اعتقاده هذا أي تحول أو أي تفاعل كيميائي أنه ممكنا سواء نشر حرارة أم لم تصدر منه حرارة. وكان ذلك بأخذه في الاعتبار شق المعادلة المعبر عن تغير الإنتروبيا (T* {\displaystyle \Delta } S).
وعلى سبيل المثال :
عند إذابة سلفات الصوديوم في الماء تنخفض درجة حرارة المحلول عن درجة حرارة الغرفة. فيكون شق الإمنتروبيا في المعادلة ذو إشارة موجبة ، وعلي الرغم من ذلك تتزايد درجة عدم الانتظام في المحلول ، أي تزداد انتروبية النظام بذوبان السلفات.
عند انصهار قطعة من الثلج يحتاج الثلح حرارة من الخارج لكي يتحول من طور الثلج (مادة صلبة) إلى سائل (طور السائل.
لا ترتفع درجة حرارة الماء على الرغم من اكتساب قطعة الثلج حرارة من الجو المحيط ، وتتزايد درحة عدم الانتظام وبالتالي تتزايد إنتروبية الجزيئات في الطور السائل عنه في الطور الصلب.
تحول الكربون في وجود ثاني أكسيد الكربون لإنتاج أول أكسيد الكربون هو تفاعل كيميائي يتميز بإنثالبية تفاعل موجبة الإشارة. وعن طريق “إنتروبية التفاعل” يمكن إزاحة توازن التفاعل (انظر توازن بودوارد) في اتجاه إنتاج أول أكسيد الكربون برفع درجة الحرارة.
أنواع تغير الحالة[عدل]
مقالة مفصلة: دورة حركة حرارية
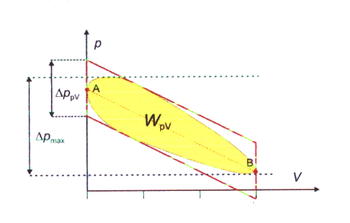
شكل الضغط والحجم للدورة الترموديناميكية
تحول عكوس: تحول يتم ببطء شديد ، يمكن للنظام الحراري في أي نقطة منه العودة في الاتجاه المعاكس معيداً وبدقة تامة جميع الشروط التي قد مرت به في التحول الأصلي المباشر ، ويسمى هذا التحول بالتحول الفيزيائي.
تحول لاعكوس: تحول سريع غير قابل للعكس. وتتصف جميع التحولات الطبيعية بأنها لاعكوسية؛ ويسمى هذا التحول بالتحول الكيميائي والسبب تكون ماده جديده.
الدورة المغلقة: تحول يعود فيه النظام إلى نقطة البدء بعد أن يكون قد مر بعدة مراحل مختلفة.
متغيرات مترافقة[عدل]
الفكرة الأساسية في الترموديناميكا هي الطاقة. يقول القانون الأول للديناميكا الحرارية أن الطاقة الكلية في نظام والوسط المحيط بالنظام تكون ثابتة لا تتغير. فيمكن للطاقة الانتقال إلى النظام عن طريق التسخين أو زيادة الضغط ، أو زيادة كمية المادة فيه ، كذلك يمكن استخراج طاقة من النظام بالتبريد أو بالتمدد في حجم النظام أو استخراج جزء من مادته.
 موقع المهندس موقع المهندس بيت كل مهندس
موقع المهندس موقع المهندس بيت كل مهندس