هي كمية الحرارة اللازمة لرفع درجة حرارة 1 كيلوجرام من المادة درجة مئوية واحدة (أو مطلقة) وبذلك تكون وحدتها هي جول لكل كيلوجرام لكل درجة.
وحدة قياسها هي : جول / (كجم. ْم) أو جول / (كجم. كلفن) (ملحوظة: طبقا للتعريف القديم كانت الحرارة النوعية لمادة هي كمية الحرارة اللازمة لرفع درجة حرارة 1 جرام من المادة درجة مئوية واحدة. فكانت وحدتها سعرة/جرام/درجة).
والجدول أدناه يبين الحرارة النوعية لبعض المواد :
المادة جول /(كجم. درجة مئوية واحدة)
الماء 4180
زيت الزيتون 1971
ألمنيوم 895
زجاج عادي 832
نحاس 389
فضة 234
الزئبق 139
الذهب 125
وسبب اختلاف الحرارة النوعية من مادة إلى أخرى يعود إلى مدى تراص وترابط ذرات المادة ومن ثم قدرتها على احتواء للحرارة.
السعة الحرارية[عدل]
مقالة مفصلة: سعة حرارية
هي كمية الحرارة اللازمة لرفع درجة حرارة كمية معينة من مادة ما درجة مئوية واحدة.
القانون الأساسي في الديناميكا الحرارية[عدل]
نظام دينامي حراري : يدخل الوسط الفعال ساخنا (يسار) ويخرج (يمينا) باردا. يستخلص العمل باستخدام سلسلة من الأسطوانات.
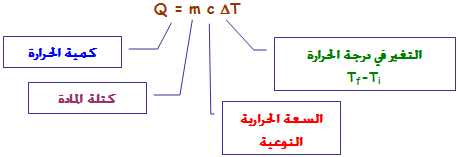
يمكن حساب كمية الحرارة Q التي يكتسبها جسم كتلته M وارتفعت درجة حرارته مقدار dT من العلاقة :
Q = M. C. dT
أي أن “كمية الحرارة ” اللازمة لرفع درجة حرارة كتلة معينة M من المادة إلى فرق في درجة الحرارة dT ، هو حاصل ضرب الكتلة M في الحرارة النوعية C للمادة في فرق درجات الحرارة. تقاس كمية الحرارة بوحدة الجول.
مع ملاحظة أن :
كل معادلة في الفيزياء والكيمياء لا بد وان تكون متجانسة الوحدات ، بمعنى:
كمية الحرارة M = Q كيلوجرام. C جول/(كيلوجرام.كلفن). dT كلفن
= جول
قوانين الديناميكا الحرارية الأربعة[عدل]
مقالة مفصلة: قوانين الديناميكا الحرارية
القانون الصفري للديناميكا الحرارية[عدل]
مقالة مفصلة: القانون الصفري للديناميكا الحرارية
إذا كانت حرارة الجسم أ تساوي حرارة الجسم ب وحرارة ب تساوي حرارة ج فإن حرارة أ تساوي حرارة ج.
القانون الأول للديناميكا الحرارية[عدل]
مقالة مفصلة: القانون الأول للديناميكا الحرارية
ينص على أن الطاقة في النظام تساوي العمل المبذول (المضاف أو المنتزع) يضاف إليها الطاقة الداخلية (المضافة أو المنتزعة).
أي في نظام مغلق :
dQ= dU + dW
حيث (dQ)هي كمية الحرارة التي تخرج من أو تنتقل إلى النظام
 موقع المهندس موقع المهندس بيت كل مهندس
موقع المهندس موقع المهندس بيت كل مهندس